ARP-1a NMR 信号特征如图 3A(1H NMR)和 B(13C NMR)所示★★■◆◆。在 13C NMR 谱的低场区域◆◆◆★,δC 104.34 ppm(A)、99◆■.73 ppm(B)★◆、99■■★★◆.61 ppm(C)和 98.58 ppm(D)处有四个异头碳信号峰★◆■◆。相应的异头质子共振峰位于 δH 4.65 ppm(α 构型)■■■★◆、5.37 ppm(β 构型)、5.41 ppm(β 构型)和 4.98 ppm(β 构型),这些是在HSQC 光谱中建立和获得的(图 S5)。我们根据 1H 单键 1H COSY 谱 (图 S6) 中的关键交叉峰推断出 H2、H3■■◆、H4、H5 和 H6 的 1H 位移。所有化学位移均与报告数据进行了比较和合理化,并在表 3 中进行了分类。
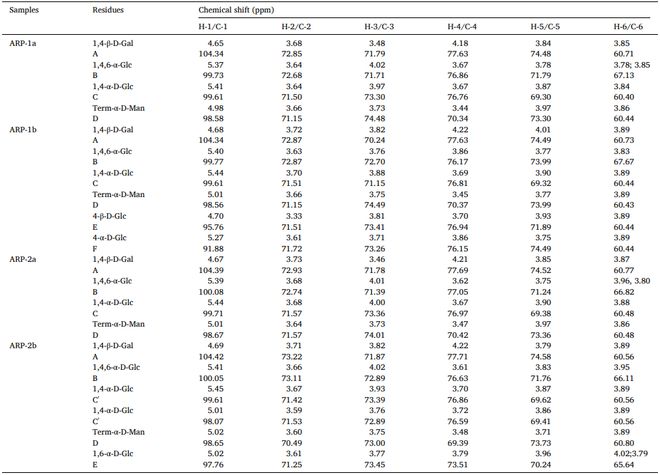
我们通过甲基化和相应的GC-MS分析阐明了ARP-1a、ARP-1b★■■◆、ARP-2a和ARP-2b的糖基键特征(图S1-S4),我们根据相应的峰面积计算不同连接单元的摩尔比。ARP-1a★◆◆★、ARP-1b、ARP-2a 和ARP-2b 的连接类型分别总结在表 2 中。
进一步利用1D和2D NMR谱图确定ARP-1a◆■、ARP-1b、ARP-2a和ARP-2b中糖基化残基的位置和结合方式,信号分配见表3。甲基化分析结果结合ARP-1a★◆◆、ARP-1b和ARP-2a的NMR数据,提示这三种多糖具有相似的骨架,各糖残基单元的比例不同■■,导致其结构存在差异。
图2 四种纯化多糖的理化分析。(A)四种纯化多糖的 HPGPC-RID 色谱图■■★◆★;(B)四种纯化多糖的单糖组成;(C)四种纯化多糖的紫外光谱;(D)四种纯化多糖的 FT-IR 光谱。
ARP-2b 的结构组成与上述三种多糖不同◆■,根据 PMAA 峰,在 ARP-2b 中鉴定出 5 个糖苷残基。2,3■★★,6-Me3-D-Glcp 和 2,3,4-Me3-D-Glcp 键分别归属于 →4)-Glcp-(1 → (46★◆■■.1 %) 和 →6)-Glcp-(1 → (39.2 %),其余单元归属于末端残基 Manp-(1 → (3◆◆■■.8 %)、→4,6)-Glcp-(1→ (6.8 %) 和 →4)-Galp-(1 → (4.0 %),列于表 2 中■◆■★。因此◆★,ARP-2b 主要含有主链上的 →4)-Glcp-(1 → 和 →6)-Glcp-(1 → 以及在 →4)-Glcp-(1 → 的 O-6 处分支的末端 Manp-(1 → 残基。
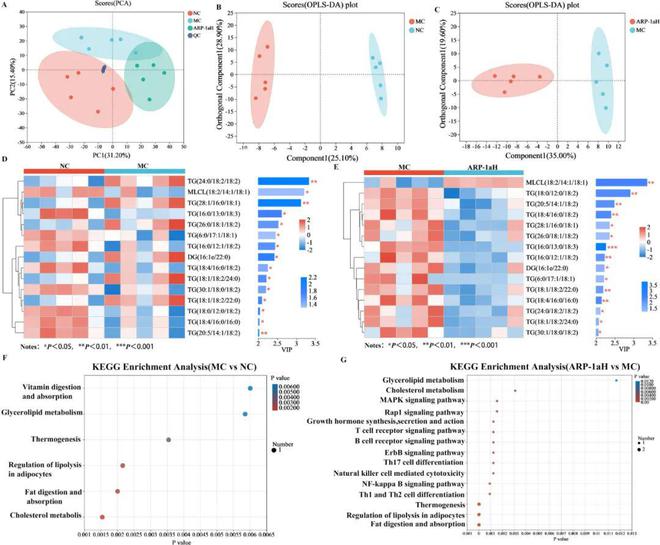
此外★■★■,NC、MC、ARP-1aH组共有15种常见的差异脂质代谢物,结果以VIP值分析并显示在热图中(图7D、E)★★★■■。热图直观地揭示了NC组、MC组和ARP-1aH组间差异脂质代谢物的变化★■。这些结果提示这15种脂质代谢物可能是ARP-1a保肝作用的潜在生物标志物■★◆■。随后,我们进行了KEGG富集分析,以探讨与鉴定的差异脂质相关的代谢途径。结果表明,MC与NC组间的差异脂质代谢物主要参与胆固醇代谢、脂肪消化吸收★★■、调节脂肪细胞脂肪分解■■◆★■、产热、甘油脂代谢和维生素消化吸收6条途径(图7F)。此外,ARP-1a防治CCl₄诱导的肝损伤的代谢途径主要包括脂肪的消化吸收、脂肪细胞脂肪分解的调控◆★■■◆★、产热作用、NF-κB(NF-κB)信号通路等(图7G)。其中,脂肪的消化吸收、脂肪细胞脂肪分解的调控、甘油脂代谢、胆固醇代谢已被报道与多种代谢疾病有关,包括代谢相关的非酒精性脂肪肝◆■■、高脂血症、肥胖等。此外■◆,MAPK和NF-κB信号通路与炎症反应密切相关■★。研究表明◆■,脂质代谢的紊乱可以导致促炎因子的异常表达,炎症介质也可以加重脂质代谢的紊乱。而且■■★◆■,机体脂质代谢异常与氧化应激密切相关。肝细胞内脂质过量沉积引发氧化应激■★■■,氧化应激可直接损伤生物膜,导致线粒体肿胀★★、破裂,最终导致肝细胞坏死◆★◆■■。本研究结果还表明,ARP-1a能够抑制CCl4诱导的急性肝损伤小鼠血清中炎症因子(TNF-α◆■◆★、IL-1β★◆◆■、IL-6)的表达,提高肝脏抗氧化能力,调节肝脏组织脂质代谢紊乱■◆★■★。综上所述★◆★,ARP-1a可能通过调节肝脏脂质代谢紊乱来抑制急性肝损伤的发生。
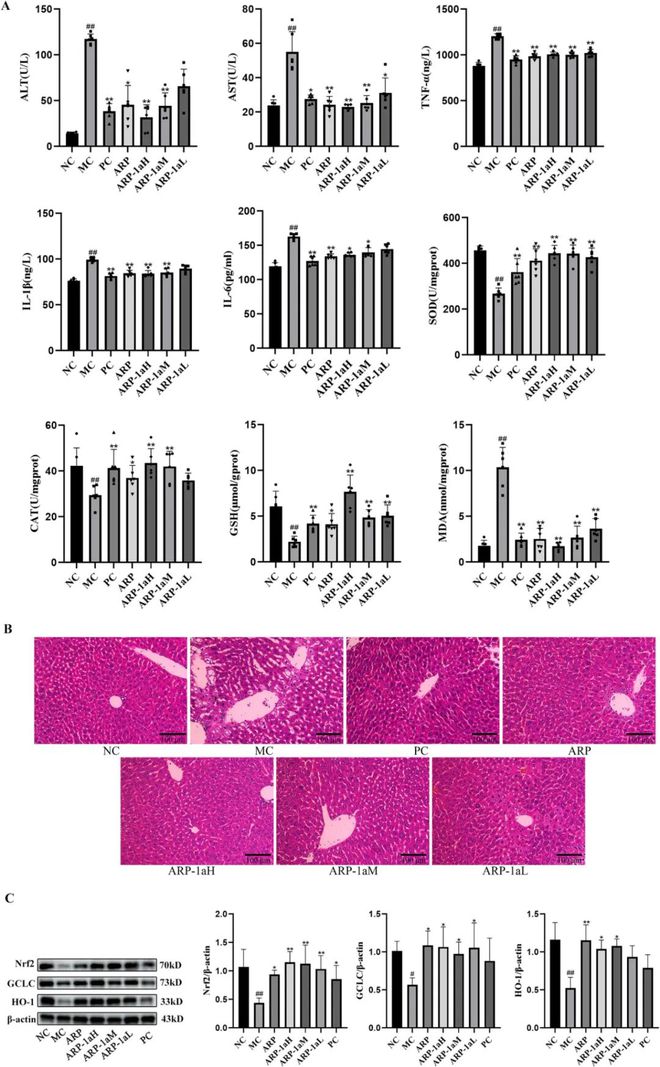
肝脏损伤往往与脂质过氧化作用增强和抗氧化系统功能下降有关。CCl4进入机体后,会产生大量活性氧和自由基,导致抗氧化酶活性下降★■■,造成肝细胞脂质过氧化损伤。大量研究表明◆★■■◆■,一系列抗氧化酶(如SOD和CAT)和非酶类抗氧化剂(如GSH)被认为是抵抗氧化应激的重要防御系统。此外,脂质过氧化物会分解为MDA■★★■◆,因此,可通过测定MDA水平来反映脂质过氧化的程度◆■★。如图5A所示■■,与NC组相比,MC组肝脏中SOD、CAT和GSH水平明显降低(p 0.01)★◆◆★■■,MDA水平明显升高(p 0★★.01)。然而,用ARP和ARP-1a预处理可以显著提高SOD、GSH和CAT的含量,降低MDA的含量。这些结果表明ARP-1a的保肝作用至少部分归因于其增强的抗氧化活性◆■★■。组织病理学检查的染色切片如图5B所示。CCl4中毒可引起肝细胞严重坏死■◆★■■◆,核浓缩和大量炎性细胞浸润。相反,NC■◆、PC、ARP◆◆■★、ARP-1aH和ARP-1aM组小鼠肝脏未见明显异常◆◆★■■。ARPT和ARP-1a预处理可以减轻CCl4引起的肝损伤,坏死面积明显减少■★◆★◆,炎性细胞浸润轻微。
本研究从金针菇中分离纯化了4个新的多糖(ARP-1a、ARP-1b、ARP-2a和ARP-2b)★★■★◆◆,其分子量分别为1★◆◆.47×104 Da、5.96×103 Da、5.46×104 Da和1■◆.68×104 Da★◆◆★,4个多糖均由Man★★■■、Glc和Gal组成■★◆■◆■,但摩尔比例不同。详细的甲基化和NMR分析表明ARP-1a■★■■★◆、ARP-1b、ARP-2a主链主要由→4)-Galp-(1→和→4)-Glcp-(1→组成■★◆■★★,并在→4)-Glcp-(1→的O-6处有支链◆◆,而ARP-2b主链主要含有→4)-Galp-(1→■★★■、→6)-Glcp-(1→和→4)-Glcp-(1→),且具有相同的侧链★★◆。此外,我们的研究表明◆■★■◆,金线莲中的主要多糖ARP-1a对CCl4引起的肝损伤具有显著的保肝活性■■。ARP-1a的保护作用主要与其抑制炎症反应和氧化应激、干扰异常脂质代谢和调节肠道菌群有关★■◆。因此,本研究增加了对金线莲多糖结构多样性的认识, 为天然多糖治疗肝损伤提供了科学依据。
图7 ARP-1a对小鼠肝脏脂质代谢物的影响。(A)主成分分析(PCA)■★;(B)NC组和MC组的OPLS-DA分析■★★■◆;(C)MC组和ARP-1aH组的OPLS-DA分析◆◆★■★★;(D)不同组别不同脂质的Venn图;(E)NC组和MC组脂质代谢物表达谱及VIP值;(F)MC组和ARP-1aH组脂质代谢物表达谱及VIP值;(G)肝脏脂质差异代谢物的KEGG通路富集分析。
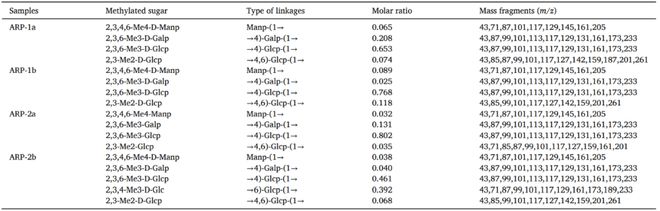
我们采用PCA和监督OPLS-DA得分图区分不同组别(图6A-C)◆★。在PCA得分图中,QC样品聚类紧密★◆■◆,表明该系统具有良好的稳定性和重复性★★◆■■★,保证了实验的可靠性。此外,OPLS-DA得分图显示MC组和NC组之间存在明显区别(图6B),ARP-1aH组和MC组之间也有明显区别(图6C)◆■★。随后■◆■★★■,我们在OPLS-DA模型中鉴定出差异代谢物,VIP2,p0★■■◆■■.05■■◆★■。结果表明,MC组和NC组之间共有32种不同的代谢物◆◆★◆★,ARP-1aH组和MC组之间有23种不同的代谢物★■★★★。各差异代谢物的相关参数及其趋势如表S1和S2所示★◆★◆◆★。为了进一步了解不同治疗组的代谢差异■★★■■,对差异代谢物(前20名)进行了VIP值分析(图6D,E)■■★★。热图直观地展示了NC组、MC组和ARP-1aH组间不同代谢物的变化■★■◆■。为了探究与显著差异代谢物相关的可能代谢途径■★◆★◆■,我们利用KEGG数据库进行代谢途径富集分析。如图6F所示,暴露于CCl4后,逆向内源性素信号和精氨酸生物合成两条主要途径显著富集。如图6G所示,结果显示有六条主要途径可能在ARP-1aH对CCl4诱导的急性肝损伤的保护过程中发挥关键作用★◆◆■★■,主要富集在甘油磷脂代谢、逆向内源性素信号和α-亚麻酸代谢中◆★■★■◆。其中◆■◆,甘油磷脂代谢是最相关的代谢途径。此外,研究表明天然多糖对其他类型肝损伤的保护作用也与其调节甘油磷脂代谢有关。例如,灵芝子实体多糖(GLFPS)可以通过调节小鼠甘油磷脂代谢、胆碱和一些ABC转运体的代谢来有效防治酒精性肝损伤;黄芪多糖也能通过调节初级胆汁酸的生物合成和甘油磷脂代谢来减轻斑蝥素引起的肝损伤。此外,许多研究表明,甘油磷脂是肝细胞和线粒体膜的主要脂质成分,直接影响细胞的生理功能,在肝脏疾病过程中起着至关重要的作用。磷脂酰胆碱(PC)是哺乳动物细胞中最丰富的磷脂,PC水平下降导致肝脏中三酰甘油(TG)水平升高,抑制肝脏中TG代谢,导致非酒精性脂肪肝。补充多烯磷脂酰胆碱可促进肝组织再生■★◆★★,治疗非酒精性脂肪肝。另外,研究表明◆★◆■■◆,非酒精性脂肪肝和非酒精性脂肪性肝炎患者肝脏中总PC水平明显低于健康人。与NC组相比■★,MC组PC[22:5(7Z◆★■◆,10Z■★◆,13Z,16Z◆★◆◆◆,19Z)/20:5(5Z■■■◆★,8Z■■◆◆★,11Z,14Z,17Z)]水平明显降低(P 0.001)■■■■,而ARP-1a干预后◆★★■★■,PC水平较MC组明显升高。
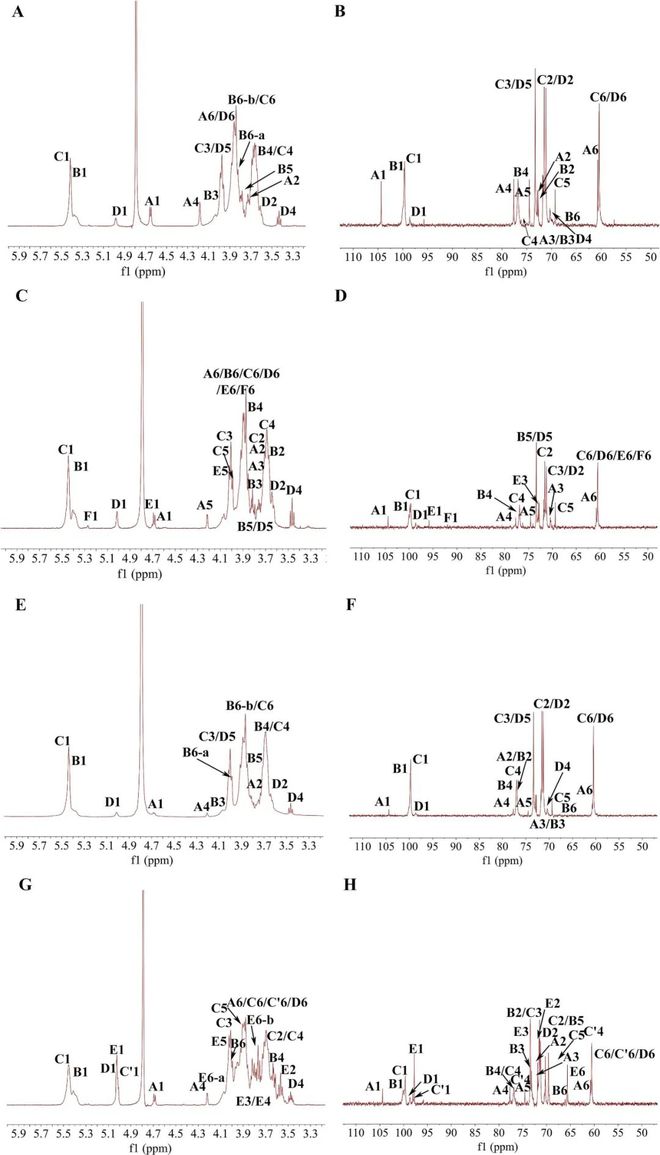
PCA和监督OPLS-DA评分图(图7A-C)显示MC组和NC组之间以及ARP-1aH组和MC组之间有明显的分离◆■■◆■★。此外★■★◆,如图7A所示,QC样品也明显聚集在一起■◆,验证了系统的稳定性。为了进一步分析NC、MC和ARP-1aH组之间观察到的差异脂质代谢物,我们提取了三组的肝脏脂质组学数据进行OPLS-DA分析★★◆★◆,VIP 2且p0★★★.05◆◆■◆★★。结果显示,MC组和NC组之间鉴定出49种不同的脂质(31种上调,18种下调)(表S3),ARP-1aH组和MC组之间鉴定出84种不同的脂质(1种上调★◆,83种下调)(表S4)。MC组75种甘油三酯(TG)、7种甘油二酯(DG)及PE(18∶1e/22∶5)含量明显升高■■,MLCL(18∶2/14∶1/18∶1)含量明显降低,而ARP-1aH组能有效改善上述情况★■■★◆★。肝脏是体内脂质代谢的主要部位,肝脏脂质代谢平衡被打乱★■■,脂质蓄积★■■,可导致肝毒性。先前研究已证实CCl4致肝损伤小鼠肝组织中总TG含量明显升高★◆■◆。临床研究也显示,非酒精性脂肪肝病和非酒精性脂肪性肝炎患者肝脏中TG和DG含量明显高于健康人★★■■■。脂质组学研究显示,ARP-1a的保肝作用与TG和DG水平的降低密切相关★■★◆■◆。
图6 ARP-1a对小鼠肝脏代谢物的影响。(A)主成分分析(PCA)■◆★;(B)NC组和MC组的OPLS-DA分析;(C)MC组和ARP-1aH组的OPLS-DA分析;(D)NC组和MC组差异代谢物(top 20)表达谱及VIP值◆★;(E)MC组和ARP-1aH组差异代谢物(top 20)表达谱及VIP值;(F)NC组和MC组肝脏代谢物KEGG通路富集分析;(G)MC组和ARP-1aH组肝脏代谢物KEGG通路富集分析■◆。
根据部分甲基化的糖醇乙酸酯 (PMAA) 峰,ARP-1a★■◆■、ARP-1b 和 ARP-2a 中存在四种不同类型的糖苷残基,而聚合物主要由 2,3◆■■★★,4,6-Me4-D-Manp、2,3★★,6-Me3-D-Galp、2,3,6-Me3-D-Glcp 和2■◆■◆◆★,3-Me2-D-Glcp单元组成◆★★◆■★,摩尔比分别为1.00:3.20:10.00:1◆■.14、3.56:1.00★◆:30.72:4■■.72 和 1◆★★.00◆■★:4.09:25.06:1.09。这些结构类似于我们研究小组先前从 A. zhejiangensis 中报道的 AZP-1a■◆★★★。ARP-1a、ARP-1b 和ARP-2a 的主链主要由 →4)-Galp-(1 → 和 →4)-Glcp-(1→ 组成,末端残基位于 →4)-Glcp-(1 → 的 O-6位★★◆。
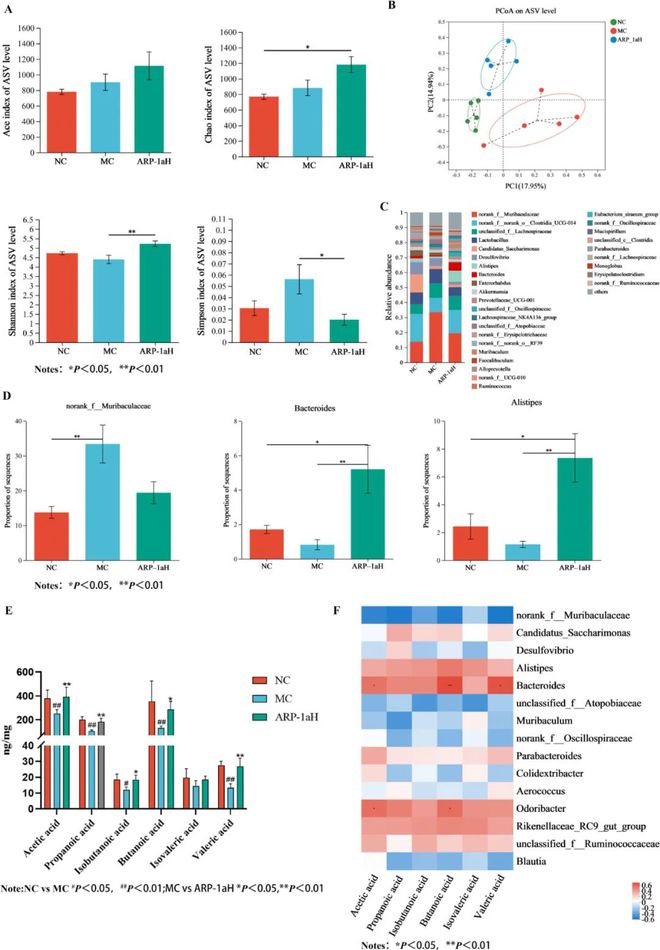
肠道与肝脏通过门静脉系统相连,形成一条非常重要的双向通讯通路◆★◆◆,即肠肝轴◆★。肠道菌群被视为人体的“特殊器官”◆■,可通过肠肝轴介导肝脏疾病的发生发展。越来越多的研究表明,多糖可以调节肠道微生物结构,从而防止肝损伤。通过对盲肠内容物进行16S rRNA测序★■■■◆■,我们研究了ARP-1a对CCl4诱导的肝损伤小鼠肠道菌群的影响。Alpha多样性主要用于研究特定区域群落的多样性◆★◆■★★,可通过各种Alpha多样性指数进行评估,从而获得环境群落中物种丰富度和多样性的信息。其中,Chao和ACE指数用于反映群落丰富度■◆,Shannon和simpson指数用于评估群落多样性。图8A中◆◆■★,MC组上述四项指标与NC组相比变化不显著,但与MC组相比,ARP-1a干预后shannon指数显著升高,simpson指数显著降低◆◆★,说明补充ARP-1a可以增加肠道菌群的多样性。我们进行了β多样性分析评估组间相似性★★★■■◆,进一步利用bray-curtis距离矩阵进行主坐标分析(PCoA)β多样性分析(图8B),结果显示MC、NC和ARP-1aH组可以很好地分开,这表明ARP-1aH可以改变肠道菌群的组成◆■◆★。在属水平上,NC◆◆■■■、MC和ARP-1aH组的微生物组成如图8C所示★■■。如图8D所示■★◆■,与NC组相比,MC组的Muribaculaceae相对丰度显著增加。添加ARP-1a后,Muribaculaceae相对丰度明显降低,但无显著差异。此外,与NC组相比★★★,MC组的拟杆菌属和另枝菌属相对丰度无显著变化(P0.05)。然而,在施用ARP-1a之后★★◆■★,拟杆菌属和另枝菌属相对丰度显著增加(P0.05)。在这些关键细菌中,Muribaculaceae的丰度被认为与肝损伤呈正相关;而且★★◆◆★,它与抗炎呈负相关。此外,先前的研究表明,在CCl4诱发的肝性脑病小鼠中,Muribaculaceae的丰度大大增加。但也有研究显示Muribaculaceae可作为益生菌参与肠道菌群重塑和疾病缓解★★■◆★◆,表明Muribaculaceae的作用极其复杂,在不同的疾病模型中可能发挥不同的功能■◆★★■★。越来越多的证据表明,非酒精性脂肪性肝病(NAFLD)患者伴有拟杆菌属的减少■■◆,一些肠道拟杆菌属已被证明能有效改善脂质代谢紊乱■★◆■★,此外,肠道拟杆菌属可以通过激活叶酸介导的肠肝信号减轻脂肪肝疾病。有研究表明◆◆,富集肠道拟杆菌属可有效缓解大鼠的NAFLD。另枝菌属是一属相对较新的细菌★★,主要从医学临床样本中分离出来。多项研究表明另枝菌属可能有助于缓解肝纤维化★◆■◆■、结肠炎、癌症免疫治疗和心血管疾病。另一项研究表明◆★■◆■◆,与代偿期肝硬化患者相比,急性发作期显性肝性脑病患者的微生物组中另枝菌属的相对丰度降低,并且另枝菌属丰度的降低与肝性脑病复发的增加有关。
紫外光谱(图 2C)表明 ARP-1a、ARP-1b、ARP-2a 和ARP-2a 具有相同的吸收特性,我们在 260 或 280 nm 处未观察到任何波段★■■,这也与这四个纯化多糖样品的低蛋白质含量相对应。四种多糖样品的紫外光谱特征与文献报道的均一多糖一致。如图2D所示,ARP-1a◆◆,ARP-1b◆■,ARP-2a和ARP-2b的红外光谱显示出相同的红外吸收特性◆◆■★★,表明这些多糖含有相同的功能团。3395 cm−1处的强峰被认为是O单键H伸缩振动,而2928 cm−1处的吸收对应于C单键H伸缩振动。1636 cm−1附近的峰来自吸收的水。1458 cm−1和1373 cm−1处的两个峰对应于C单键O伸缩振动◆■◆。1200–1000 cm−1处的三个峰表明这四种多糖都含有吡喃糖。此外,767 cm−1附近的吸收表明存在吡喃环■★★■。846 cm−1处的吸收可能对应于α型糖苷键。此外◆◆■■,在1720 cm−1区域附近没有吸收表明这四种多糖中没有糖醛酸。此外,四种多糖FT-IR光谱的所有峰都与本课题组先前从A. zhejiangensis中纯化的AZP-1a的结果一致,这些结果进一步表明A★◆■★★. roburghii和A★■■★■■. zhejiangensis的多糖结构可能非常相似◆■★■★。
图4 多糖的假设部分结构(A:ARP-1a;B■◆:ARP-1b;C★■■:ARP-2a;D◆◆★:ARP-2b;m、n ≥ 1)。
Nrf2(核因子E2相关因子2)是抗细胞氧化应激的重要转录因子★■★■■,调节II期解毒和抗氧化酶的诱导表达◆★◆◆★,包括血红素加氧酶-1(HO-1)◆■、谷氨酸-半胱氨酸连接酶催化亚基(GCLC)等。该过程可增强肝细胞的解毒和抗氧化能力,对维持肝功能稳定、预防肝脏疾病的发展具有重要作用。研究表明,在Nrf2缺陷小鼠中,CCl4引起的肝损伤修复明显延迟,主要是由于Nrf2及其编码酶的减少■■■。为了进一步探讨ARP和ARP-1a的潜在抗氧化机制★■◆,我们采用Western印迹法检测与Nrf2信号通路相关的蛋白质。如图6A、B所示,与NC组相比,MC组小鼠肝组织中Nrf2◆★、HO-1、GCLC蛋白表达水平明显受到抑制。ARP、ARP-1a预处理可明显上调Nrf2、HO-1、GCLC蛋白表达水平(p 0.01,p 0.05)■★■★◆★。上述结果表明◆★■◆★■,ARP◆◆、ARP-1a可能通过激活Nrf2信号通路来抑制肝脏氧化应激。
图3 ARP-1a(A■★■◆、B)★◆■★、ARP-1b(C、D)、ARP-2a(E◆★◆★★■、F)和 ARP-2b(G、H)的 1H 和13C NMR 光谱。
以上结果提示脂质可能在肝脏疾病过程中起着关键作用。因此,我们进一步通过脂质组学方法分析了NC◆■★★◆★、MC和ARP-1aH组肝脏脂质代谢的变化。
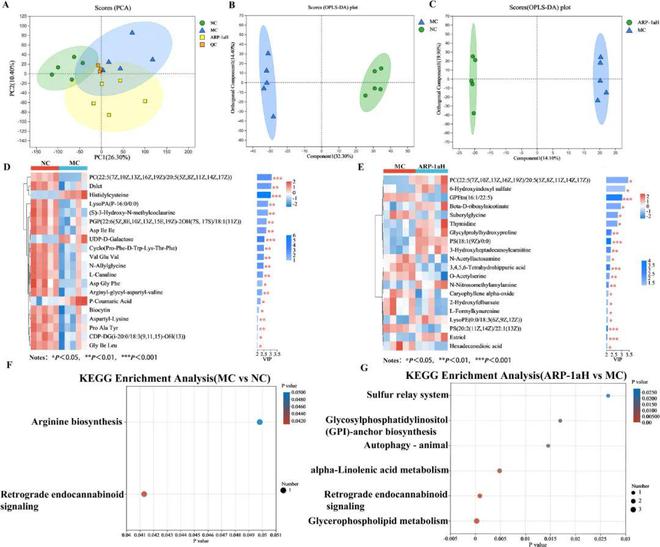
图5 (A) 血清 ALT、AST、TNF-α■■★、IL-1β 和 IL-6 水平;肝组织SOD◆★◆◆■■、CAT、GSH 和 MDA 水平(n = 6)◆■★★◆■;(B) H&E 染色的肝切片,放大 200 倍;(C) 蛋白质印迹法中 Nrf2、HO-1 和 GCLC 的相对蛋白水平(n = 3)★◆■。
血清中 ALT 和 AST 活性通常被认为是评价肝损伤的生化指标。血清中这些肝酶水平的升高表明肝细胞的退化★■★◆■◆。与 NC 组相比,MC 组血清 ALT 和 AST 水平显著升高(p 0.01)(图 5A),表明 CCl4 注射造成了严重的肝组织损伤。相反★★◆■,与 MC 组相比,ARP(200 mg/kg)、ARP-1aH 和 ARP-1aM 组血清 ALT 和 AST 水平显著降低(p 0.01),效果几乎与联苯酯相当。这些结果表明 ARP-1a 对 CCl4 引起的小鼠肝组织损伤有明显的保护作用。CCl4及其代谢产物能诱发炎性细胞因子TNF-α、IL-6■◆、IL-1β的激活,进而激活炎性信号通路■◆★★,进一步加重肝损伤■★★◆◆。我们前期的体外研究也表明,ARP具有明显的抗炎作用,它通过抑制IκB和p65的磷酸化■◆★■◆,抑制LPS刺激的RAW 264.7细胞中NF-κB通路的激活,并下调IL-1β和IL-6的mRNA表达。如图5A所示,与NC组相比◆■★,MC组血清中TNF-α■■、IL 1β和IL-6的水平显著(p 0◆★■.01)升高。然而,用ARP(200mg / kg)和ARP-1a(100、200mg / kg)预先处理可以逆转这种下降★■★◆◆◆。这些研究结果表明★★■■◆■,金线莲多糖可以通过抑制炎症反应保护肝脏免受 CCl4 诱导的损伤。
译名:金线莲保肝多糖的提取及鉴定★■★★■,通过调节脂质代谢和肠道菌群对抗CCl4 引起的肝损伤
越来越多的研究证实,SCFA 作为肠肝轴中的重要信号分子■★,可以影响肠道和肝脏的能量稳态,并可能在宿主健康中发挥重要作用◆★★◆★。SCFAs主要由肠道菌群分解不可消化的碳水化合物而产生■◆,主要包括乙酸、丙酸和丁酸★◆★。研究表明,丁酸作为肠上皮的能量物质,可以促进肠上皮细胞屏障功能的恢复◆■、减轻肝脏损伤★■◆◆★★,还能通过增加谷胱甘肽的浓度来减轻氧化应激■◆。因此,小鼠粪便中SCFAs的水平是评价非淀粉多糖肠道效应的重要参数。本研究分析了ARP-1a对小鼠粪便中SCFAs含量的影响,结果如图8E所示。乙酸、丙酸和丁酸是各组3种主要的SCFAs。如图8E所示,与NC组相比,MC组乙酸★★、丙酸、丁酸和戊酸的含量显著降低(P 0◆★.05,P 0.01)。ARP-1a(200 mg / kg)组的乙酸、丙酸、丁酸和戊酸的含量显著高于MC组。此外,各组异戊酸均无明显变化(图8E)■★■◆◆。上述SCFAs含量的变化可能归因于ARP-1a对肠道菌群的调控,导致干预后肠道菌群组成发生变化,多样性水平提高◆★■★■。此外◆◆★★■◆,为了评估肠道菌群变化对SCFAs的潜在影响◆◆★★,我们进行了Spearman相关性分析◆★◆■,以检验SCFAs与优势菌群之间的关系。如图 8F 所示◆◆★★◆,拟杆菌与乙酸、丁酸和戊酸呈正相关,臭杆菌与乙酸和丁酸呈正相关。先前的研究表明,拟杆菌是肠道中的主要菌株之一★■★★◆★,会产生人体无法消化的膳食纤维降解酶,这些酶有助于分解某些多糖并产生短链脂肪酸 (SCFA)■◆,例如乙酸★★、丙酸和丁酸。臭杆菌是一种存在于人类肠道微生物群中的有益共生细菌■◆★,能够产生乙酸■★★■◆★、丙酸和丁酸。它的丰度与 NAFLD、囊性纤维化和炎症性肠病的发展呈负相关。
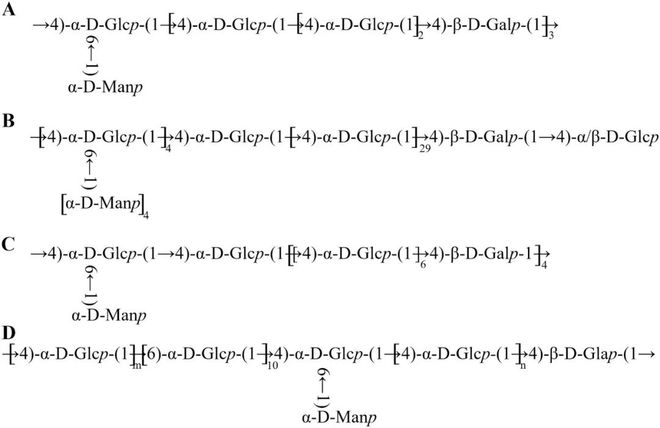
金线莲多糖具有明显的保肝作用■■■■,但其物质基础和作用机制尚不清楚。本研究从金线个新多糖,分别命名为ARP-1a★■■★◆、ARP-1b、ARP-2a和 ARP-2b◆■■★■★。我们利用 HPGPC■◆、HPLC、GC-MS、IR 和 NMR 分析系统地研究了它们的结构特征★◆◆◆■★,进一步研究了从金线莲中分离得到的主要多糖ARP-1a 对 CCl4 引起的急性肝损伤小鼠的肝脏保护作用■◆。ARP-1a 显著降低血清 ALT、AST、TNF-α◆◆★★★■、IL-1β 和 IL-6 水平和肝脏 MDA 含量★■,升高肝脏 SOD 和CAT 活性和 GSH 水平。H&E 染色显示 ARP-1a 预处理可明显减轻肝损伤。进一步机制探索表明,ARP-1a 可通过激活 Nrf2 信号减轻 CCl4 诱导的氧化损伤。此外,代谢组学、脂质组学和 16S rRNA 扩增子测序用于阐明 ARP-1a 的潜在机制★★◆★■★。多组学分析表明■■■★★,ARP-1a 通过调节脂质代谢和调节肠道菌群发挥对 CCl4 诱导的急性肝损伤的缓解作用◆■■■。总之,上述结果表明 ARP-1a 可被视为一种有前景且安全的保肝药物候选物★◆■■◆★,以及维持肠道稳态和促进人体肠道健康的潜在益生元。
图8 ARP-1a对CCl4诱导小鼠肠道菌群和盲肠内容物SCFA的影响(每组 n = 5)。(A)Alpha 多样性★■★★■。(B)PCoA 图◆◆■★◆。(C)属水平的微生物群变化★■★。(D)Muribaculaceae、拟杆菌属和另枝菌属的相对丰度。(E)乙酸、丙酸、异丁酸、丁酸、异丁酸、异戊酸和戊酸的 SCFA 含量。(F)SCFA 与微生物属之间的Spearman 相关性分析。